News & Events
Lecture about “An Entrepreneurial Guide to the mRNA Universe”
24. September. 2024
We welcome Prof. Kenneth R. Chien to the Clinic and Polyclinic for Internal Medicine I of the TUM University Hospital rechts der Isar, who will speak on the topic “An Entrepreneurial Guide to the mRNA Universe”.
Prof. Chien (*1951) is an internationally renowned scientist in the field of cardiovascular research, with particular success in regenerative cardiovascular medicine. He developed new therapeutic approaches for the treatment of heart insufficiency. During his scientific career, he has held numerous leadership positions, including at the UC San Diego-Salk Institute, Massachusetts General Hospital and the Karolinska Institute.
Prof. Chien has a fundamental interest in the translation of new drugs. He is a co-founder of Moderna Therapeutics and an indispensable consultant to numerous biotech and big pharma companies (including Roche and Pfizer). His wealth of experience in bringing new active ingredients to the clinic for practical application is in demand in the biotech and pharmaceutical industry.
In addition, we would like to draw your attention to the offer for young scientists, a panel discussion with Prof. Kenneth R. Chien and Dr. Marijn E. Dekkers, former Bayer AG CEO.
When? September 24, 2024 at 10:00h
Location? Lecture Hall A, Klinikum rechts der Isar


Reinhart-Koselleck-Grant for Prof. Irmela Jeremias
Prof. Irmela Jeremias is a pediatrician at the Hauner Children’s Hospital of LMU and a scientist at Helmholtz München. For her research on new targets to fight leukemia, she received a Reinhart Koselleck grant from the German Research Foundation (DFG). This grant supports highly innovative and promising projects. Her project aims to “Identify new targeted cancer therapies using in vivo CRISPR/Cas9 dropout screens in PDX models”.
CNATM at the Munich Postdoc Night
CNATM will be a part of the 1st Munich Postdoc Night this fall. Don’t miss the opportunity to network with key players in Munich, listen to interesting keynote speeches and a poster session.
When & Where?
Thursday, Sept 12th, from 5:00-9:00 pm, at the Bavarian Academy of Sciences and Humanities (BAdW) at Odeonsplatz

Proof of Concept Grant for Thomas Carell
The European Research Council has awarded the LMU chemist a grant for the preclinical development of a new drug for treating leukemia in high-risk patients.
Professor Thomas Carell, Chair for Organic Chemistry and member of LMU’s Institute of Chemical Epigenetics – Munich (ICE-M), has been in receipt of a lucrative Advanced Grant from the European Research Council (ERC) since 2016. Now the chemist has been awarded a Proof of Concept Grant to build on this research. With this program, the ERC helps researchers translate their research results into practice.
Thomas Carell investigates why and how the body chemically modifies nucleic acids like DNA and RNA. One such modification is the nucleoside 5-methylcytidine, which is formed by addition of a methyl group to the canonical nucleoside cytidine by enzymes known as methyltransferases. Methylation is important for the regulation of gene activity, but can also be involved in the development of cancer. So-called hypomethylating agents specifically inhibit methyltransferases and are regularly used to treat diseases of the hematopoietic system such as AML (acute myeloid leukemia) and MDS (myelodysplastic syndrome) in older patients whose general state of health is poor. More information
Lecture Series Munich RNA Club
10. July 2024
Location: MPI of BIochemistry, T-Building, Small Lecture Hall

Symposium “New Frontier in Chemical Biology”
Joint symposium CNATM, SFB1309 and Center of Advanced Study (CAS) taking place at LMU Großhadern. We are welcoming our guests Prof. Ashraf Brik (Technion Haifa, IL), Prof. Tom Brown (Oxford, UK), Prof. Yael David (Memorial Sloan Kettering Cancer Center, New York, US), Prof. Katharina Höfer (MPI Marburg, DE) and Prof. Benjamin List (MPI Mülheim, DE, Nobel Laureate 2021).

Lecture: Towards the Structure of the HIV-1 Gag: RNA Nucleation Complex
05. Juni 2024, 13:30 Uhr
Dr. Nele Hollmann (University of Maryland (UMBC), Department of Chemistry and Biochemistry) hält einen Vortrag zu “Towards the Structure of the HIV-1 Gag: RNA Nucleation Complex”.
Ort: Bavarian NMR Center, Seminar Room, Department of Bioscience, TUM School of Natural Sciences, Garching
Lecture: Splicing activator RNPS1: Functions in the PSAP-dependent and -independent manner
03. Juni 2024, 14:00 Uhr
Prof. Akila Mayeda, (Fujita Health University, Toyoake, Japan) hält einen Vortrag über “Splicing activator RNPS1: Functions in the PSAP-dependent and -independent manner”.
Ort: Bavarian NMR Center, Seminar Room, Department of Bioscience, TUM School of Natural Sciences, Garching

EpiCure gewinnt Businessplan-Wettbewerb der BayStartUP!

Eisbach Bio – Erster Vertreter eines allosterischen Inhibitors für ALC1 erhält IND Freigabe durch FDA
Eisbach Bio GmbH (“Eisbach” or the “Company”), a privately-held clinical-stage biotechnology company pioneering cancer medicines leveraging synthetic lethality, has announced United States Food and Drug Administration (FDA) clearance of its investigational new drug (IND) application for EIS-12656, a small molecule inhibiting the chromatin helicase ALC1 (CHD1L). EIS-12656 targets ALC1 through allosteric mechanisms, suppressing the cancer-relevant genome reorganization induced by DNA damage. This leads to ALC1 chromatin trapping and cancer cell killing. more…
CNATM Lecture: Patrick Baumhof
23. Januar 2024, 17:15 Uhr
Developing mRNA based Therapeutics
In den letzten Jahren sind mRNA-basierte Therapeutika in den Mittelpunkt der Arzneimittelentwicklung gerückt. Jetzt, da mRNA-basierte Impfstoffe auf dem Markt sind, richtet sich das Augenmerk auf eine breitere Anwendung der Technologie. Als Pionier auf diesem Gebiet hat CureVac mehrere Hauptprinzipien entdeckt, die für die Entwicklung relevant sind. In der Präsentation werden verschiedene Anwendungen von mRNA in der Arzneimittelentwicklung erörtert.
Patrick Baumhof ist Senior Vize Präsident Technology bei CureVac (Tübingen).
Location: ICEM / House L, Seminarraum, Würmtalstr. 201, 81377 Munich
Für die Teilnahme ist eine Anmeldung per E-Mail erforderlich.

CNATM Meeting
18. Januar 2024
Wir möchten uns ganz herzlich bei allen Teilnehmern unseres Clustertreffens bedanken, die dazu beigetragen haben, die Veranstaltung zu einem vollen Erfolg zu machen. Die Präsentationen über den Fortschritt unserer Projekte waren spannend und haben das Engagement und die Innovationskraft unserer Clustermitglieder deutlich gemacht.
Wir freuen uns schon jetzt auf das nächste Treffen und darauf, den gemeinsamen Austausch auch in Zukunft fortzusetzen.

LMU Spin-off RNhale gegründet!
07. Dezember 2023
The formation of the biotech spinoff RNhale can be traced back to Professor Olivia Merkel’s groundbreaking research on non-viral delivery vectors for siRNA therapeutics, at Wayne State University in Michigan, USA, in 2011. After relocating to Germany and joining Ludwig-Maximilians-University Munich, her work was backed by a €2 million ERC Starting Grant (ERC-2014-StG – 637830 “Novel Asthma Therapy”). Her research then focused on developing siRNA-based drugs for asthma treatment, specifically designed for direct administration to the lungs. more…

LMU Spin-off: Gründung der QuGen GmbH
18. September 2023
Die QuGen GmbH, gegründet von Thomas Carell und Pascal Giehr, bietet hoch-sensitive Long-read Sequenzierung (PacBio), Bisulfit-freie Sequenzierung von DNA-Methylierung und Massenspektrometrische Quantifizierung von nicht-kanonischen Nukleobasen in DNA und RNA, sowie Probenvorbereitung und Datenanalyse. Damit füllt die QuGen eine Lücke in der Quantifizierung und Positionsbestimmung epigenetischer Nukleobasen.

CNATM-Lecture: Roy van der Meel
30. November 2023, 17:15
Gene Silencing in HSPCs with an Apolipoprotein A1-Based Nanodelivery Platform
Nukleinsäuretherapeutika revolutionieren die Gesundheitsfürsorge durch Hemmung, Hinzufügung, Ersatz oder Veränderung von Genen. Die Lipid-Nanopartikel (LNP)-Technologie ist die derzeitige Goldstandard-Plattform, die die klinische Umsetzung des ersten siRNA-Medikaments Onpattro und der mRNA-Impfstoffe COVID-19 ermöglichte. Die derzeitigen LNP-Systeme eignen sich jedoch hauptsächlich für Impfstoffe nach lokaler Verabreichung oder für die hepatische Verabreichung nach intravenöser Verabreichung. Um das volle therapeutische Potenzial von RNA auszuschöpfen, stellt Roy van der Meel eine modulare Nanoplattformtechnologie für die systemische Verabreichung von Nukleinsäuren an Immunzellen in hämatopoetischen Organen unter Verwendung von Apolipoproteinen vor.
Roy van der Meel ist Professor für Präzisionsmedizin in der Abteilung für Biomedizinische Technik an der Technischen Universität Eindhoven.
Veranstaltungsort: ICEM / House L, Seminarraum, Würmtalstr. 201, 81377 Munich
Für die Teilnahme ist eine Anmeldung erforderlich.

ERC Starting Grant für Dr. Daniel Andergassen
November 2023
Dr. Daniel Andergassen erhielt für seine Forschung zu molekularen Ursachen in geschlechterspezifischen Unterschieden bei Herzinsuffizenz einen ERC Starting Grant.
m4 Award für Prof. Ulrike Protzer und ihr Projekt TherVacB
25. Oktober. 2023
Prof. Ulrike Protzer und ihr Projekt TherVacB war einer der 5 Gewinner des Bayerischen m4-Preises von BioM. TherVacB ist ein Projekt zur Entwicklung eines therapeutischen Impfstoffs gegen das Hepatitis-B-Virus.
ERC Starting Grant für Prof. Baer de Oliveira Mann
September 2023
Für Ihr Projekt NTase Pro erhielt Frau Prof. Baer de Oliveira Mann einen ERC Starting Grant.
CNATM-Lecture: Muthiah Manoharan
19. Juli 2023
Living in the World of RNA Therapeutics
Synthetic small interfering RNAs (siRNAs) are potent inhibitors of gene expression. These molecules are perfect examples of biomimetic chemistry as synthetic siRNAs act through the natural RNA interference (RNAi) pathway. To deliver therapeutic siRNAs into human liver, Manoharan and his team developed approaches that include chemical modification of the siRNAs and either lipid nanoparticle (LNP) formulation or multivalent N-acetylgalactosamine (GalNAc) conjugation, making possible intravenous and subcutaneous administration, respectively. This presentation will cover the molecular basis of RNA therapeutics and their delivery including the chemical modifications and motifs used in each RNA strand to ensure uptake into cells of the targeted tissue, Ago2 recognition, silencing efficiency, metabolic stability, and safety.
Muthiah Manoharan ist Senior Vice President of Drug Discovery bei Alnylam Pharmaceuticals, Cambridge.
Ort: ICEM/ Haus L, Seminarraum, Würmtalstr. 201,81377 München
Für die Teilnahme ist eine Anmeldung erforderlich:
Link zur Anmeldung

CNATM Kick-Off Meeting
26. Juni 2023
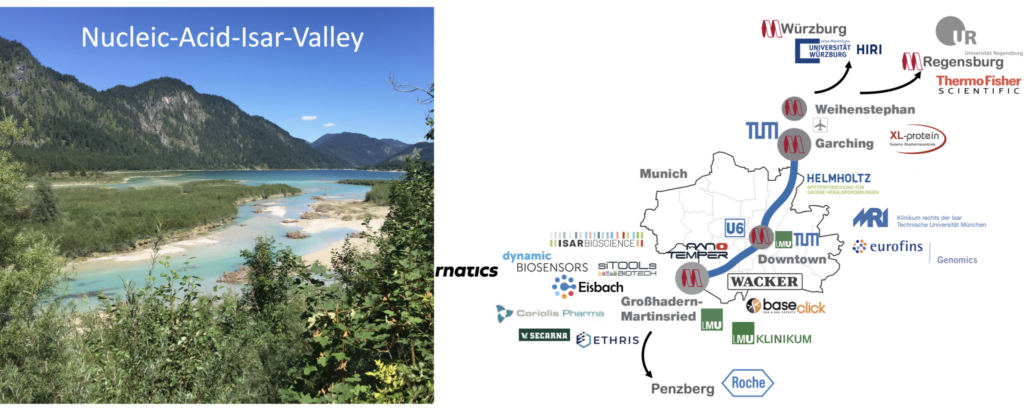
Nucleic-Acid-Isar-Valley nimmt Arbeit auf
12. Mai 2023
Am 1. Mai hat der Zukunftscluster für Nukleinsäure Therapeutika (Cluster for Nucleic Acid Therapeutics Munich, CNATM) seine Arbeit aufgenommen.
CNATM ist ein Innovationsnetzwerk aus Wissenschaft und Wirtschaft, welches mit jährlich fünf Millionen Euro vom Bund, vom Freistaat und beteiligten Unternehmen gefördert wird. Der Forschungsverbund besteht aus Wissenschaftlern*innen der federführenden Universitäten LMU und der TUM. Unter Beteiligung der Universitäten von Regensburg und Würzburg, dem Helmholtz-Zentrum München und 17 Unternehmen aus der Region um München. Insgesamt gelang es 22 Anträgen zur Förderung zu verhelfen und damit der Start des Nucleic-Acid-Isar-Valleys.
Durch die multilateralen Kooperationen des CNATM entsteht ein Netzwerk, aus dem heraus neuartige nukleinsäure-basierte Wirkstoffe und Vakzine der nächsten Generation entwickelt werden sollen. Neueste Entdeckungen lassen hoffen, dass sich mit der Möglichkeit, Nukleinsäuren hochspezifisch und theoretisch vorhersagbar designen zu können, in der Medizin ganz neue Therapieansätze eröffnen und damit viele Menschen geholfen werden kann. Es gibt keine Substanzklasse, die besser zur personalisierten Medizin passt als Nukleinsäuren. Der Zukunftscluster möchte den Nukleinsäure-Therapien zum Durchbruch verhelfen und so einen Beitrag liefern, der Sinn stiftet: Menschen heilen und Arbeitsplätze in und um München schaffen.
CNATM einer von nur 7 Zukunftsclustern in Deutschland
18. Juli 2022
Wir freuen uns sehr, deutschlandweit einer von nur 7 und in Bayern der einzige Zukunftscluster der zweiten Wettbewerbsrunde zu sein.

Unser Dank gilt allen Mitgliedern und Partner-Firmen die dies ermöglicht haben.
