Nukleinsäure-basierte Wirkstoffe für schwer therapierbare Krankheiten
Infektionen und Entzündungen sowie Tumorerkrankungen und Erkrankungen des Herz-Kreislaufsystems machen zusammen ca. 75% aller Todesfälle in der EU aus. Auch Folgeerkrankungen wie z.B. Herzinsuffizienz bei Duchenne Muskeldystrophie, tragen erheblich zur Mortalität bei.
Verfügbare Therapien in diesen Krankheitsfeldern sind oftmals nicht ausreichend effizient oder beschränken sich auf die Symptomlinderung, ohne das Fortschreiten der Erkrankung nachhaltig zu beeinflussen. Es besteht also ein erheblicher Medical Need in diesen Bereichen.
In CNATM verlassen wir die traditionelle proteinzentrierte Wirkstoffentwicklung und entwickeln Nukleinsäuren als Therapeutika. Nukleinsäuren sind die vielversprechendste Molekülklasse, um eine schnelle Entwicklung hochspezifisch wirksamer Therapeutika zu erreichen – dies zeigten bereits die mRNA-basierten COVID-19-Vakzine. In CNATM schöpfen wir ein noch breiteres Spektrum aus, das chemisch modifizierte Mono- und Dinukleotide, Oligonukleotide wie siRNAs oder Antimire sowie Aptamere mit einschließt.
Mit aktuell 11 Projekten verfolgen wir das ambitionierte Ziel, binnen weniger Jahre 10 Wirkstoffe von der Entwicklung in die Validierung und weiter in die präklinische Erprobung zu bringen.
Zu allen Projekten wurden bereits sehr vielversprechende Vorarbeiten geleistet, die zum Teil bereits so weit fortgeschritten sind, dass wir sie als „Fast-Track-Projekte“ beschleunigt in die Validierung bringen werden. Unsere 16 Industriepartner sind von Beginn an eng eingebunden und werden mit Forschungsaktivitäten, Synthesen und Wirkstofformulierungen einen wesentlichen Beitrag leisten.
Mono- und Dinukleotide
Decitabin ist ein synthetisches Nukleosid, das das Fortschreiten der akuten myeloischen Leukämie (AML) durch einen epigenetischen Mechanismus, der noch nicht vollständig verstanden ist, erheblich verlangsamen kann. Dies ist jedoch nicht bei allen Patienten der Fall, und es treten häufig toxische Nebenwirkungen auf. Vorarbeiten im WP1 haben gezeigt, dass Decitabin chemisch modifiziert werden kann, um seine Stabilität zu erhöhen und unerwünschte Nebenwirkungen zu verringern. Das Ziel dieses Arbeitspakets ist die Entwicklung von Decitabin-Analoga mit noch besseren pharmakologischen Eigenschaften.
Leiter: Thomas Carell

PIs: Thomas Carell, Pascal Giehr, Irmela Jeremias, Pavel Kielowski, Franziska Traube
Partner:

Der Stimulator of Interferon Genes (STING) ist ein Rezeptor, der bei entzündlichen und degenerativen Erkrankungen eine bedeutende Rolle spielt. Sein natürlicher Ligand ist zyklisches Guanosin-Adenosin-Monophosphat (cGAMP), welches von cGAMP-Synthase als Antwort auf DNA-Mutationen gebildet wird. Das Ziel dieses WP ist die Entwicklung synthetischer cGAMP-Analoga, die antagonistisch auf STING wirken und für die orale Therapie der AML geeignet sind.
Leiter:
Karl-Peter Hopfner

Veit Hornung

PIs: Karl-Peter Hopfner, Veit Hornung, Thomas Carell, Irmela Jeremias, Heinrich Leonhardt, Marion Subklewe
Partner:


Oligonukleotide
Die chronisch-obstruktive Lungenerkrankung (COPD) ist weltweit die dritthäufigste Todesursache. Derzeit gibt es keine Therapie, die in die zugrundeliegenden Entzündungsprozesse der COPD eingreifen kann. Vorarbeiten zu WP6 zeigten, dass der Alveolarmakrophage und seine nicht-kodierenden RNAs (ncRNAs) eine zentrale Rolle in der Entstehung von COPD haben. Ziel dieses WP ist, Antisense-Oligonukleotide gegen ncRNAs zu entwickeln, die durch Kopplung an einen Liganden eine verbesserte Aufnahme in Alveolar-Makrophagen und damit lokal erhöhte Wirkstoffspiegel erreichen.
Leiter: Stefan Engelhardt

PIs: Stefan Engelhardt, Ali Önder Yildirim
Partner:


Im Fokus des WP7 steht die Beobachtung, dass Makrophagen eine bedeutende Rolle bei der Entstehung bestimmter Tumore haben können und somit eine Verbindung zu Entzündungsprozessen besteht. Die Hinweise mehren sich, dass lange nicht-kodierende RNAs (lncRNAs) wesentliche Funktionen der Makrophagen steuern und somit therapeutisches Potential haben. Aufbauend auf einem von der AG Rad etablierten, CRISPR-Cas-basierten Screening von Tausenden lncRNAs werden geeignete Targets identifiziert und schließlich Antisense-Oligonukleotide gegen diese lncRNAs entwickelt.
Leiter: Roland Rad

PIs: Roland Rad, Stefan Engelhardt, Annalisa Marsico, Gunther Meister, Michael Sattler
Partner:

Der breite Einsatz klassischer Antibiotika birgt das Risiko von Multiresistenzen und führt zudem zu ungewollten Nebenwirkungen wie z.B. der Schädigung der natürlichen Bakterienflora. In diesem Teilvorhaben werden hochselektive RNA-Antibiotika als neuartiger Ansatz zur gezielten Bekämpfung pathogener Bakterien entwickelt. Hierbei werden Antisense-Oligonukleotide an Peptide gekoppelt, die an spezifische Oberflächenstrukturen der Bakterien binden und somit die Einschleusung des Oligonukleotids ermöglichen.
Leiter: Jörg Vogel

Delivery und Formulierung von Nukleinsäuretherapeutika
Während mRNA-Impfstoffe bei der Eindämmung der COVID-19-Pandemie eine wichtige Rolle spielten, sind keine antiviralen Mittel mit ausreichender Wirksamkeit gegen SARS-CoV2 verfügbar. Die Entwicklung synthetischer kleiner interferierender RNAs (siRNAs) gegen viral kodierte RNAs hat erste Erfolge gezeigt, aber derzeit gibt es keine klinisch zugelassenen siRNAs mit antiviraler Wirksamkeit. WP3 zielt daher darauf ab, chemisch modifizierte siRNA-Konjugate und siRNA-Formulierungen mit erhöhter Zielspezifität zu entwickeln. Wir erwarten, dass die Ergebnisse dieses WP zu neuen Ansätzen für die siRNA-basierte Therapie anderer viraler Infektionen führen werden.
Leiterin: Olivia Merkel

PIs: Olivia Merkel, Thomas Carell, Olivia Keppler, Sabine Schneider, Philip Tinnefeld
Partner:



Eine der zentralen Herausforderungen für Nukleinsäuretherapeutika ist ihre Einschleusung in Zellen (Delivery). Häufig wird hierfür die Einbettung von Nukleinsäuren in liposomale Nanopartikel gewählt – ein erprobter Ansatz, der jedoch noch Wünsche hinsichtlich der Aufnahmeeffizienz und Zell-/Gewebsspezifität offen lässt. WP4 wendet definierte Testsysteme an, in welchen Molekülbibliotheken von Trägersequenzen bzw. chemische Modifikationen iterativ für verschiedene Anwendungen untersucht und entwickelt werden (siRNA, mRNA, verschiedene Organe und Applikationswege) optimiert werden.
Leiter: Ernst Wagner

PIs: Ernst Wagner, Olivia Merkel
Partner:


mRNA-Wirkstoffe und andere Prinzipien
Der Ersatz von Uridin durch 1-Methylpseudouridin verhalf den mRNA-Vakzinen gegen COVID-19 zu erheblich verbesserten pharmakologischen Eigenschaften. Die begrenzte Haltbarkeit und die aufwändige Formulierung in Liposomen erschweren jedoch die Herstellung und vermutlich auf die Effizienz von mRNA-Vakzine. Es darf erwartet werden, dass durch weitere Modifikationen noch erhebliche Optimierungen möglich werden. Im Fokus dieses Teilvorhabens stehen die weitere chemische Modifikation von Nukleotidpositionen der mRNA (basierend auf Click-Chemie) sowie die Generierung polycistronischer mRNAs, um mithilfe eines einzigen Vakzins gegen ko-existierende Virusvarianten impfen zu können.
Leiter: Thomas Carell

PIs: Thomas Carell, Veit Hornung, Pavel Kielkowski
Partner:


WP8 adressiert zwei bedeutende und oftmals tödlich verlaufende kardiovaskuläre Erkrankungen: Carotis-Stenosen und Aneurysmen der Bauchaorta. In beiden Fällen sind Veränderungen der Gefäßstruktur ursächlich für die Erkrankung. Vorarbeiten zu WP8 zeigten bereits, dass eine kleine nicht-kodierende RNA, die microRNA miR-126-5p, im Zellkern eine ungewöhnliche Funktion als RNA-Aptamer einnehmen kann, die protektiv auf Endothelzellen wirkt. Hierbei ist die Bindung der microRNA an das Protein Mex3A entscheidend. Das Ziel dieses WP ist, Aptamere zu entwickeln, die bevorzugt an Mex3A binden, und hierauf basierend Drug-Eluting Stents zu entwickeln, die das Aptamer als protektives Agens freisetzen.
Leiter: Lars Mägdefessel

WP9 widmet sich Herz-Kreislauferkrankungen, in diesem Fall im Rahmen einer Skelettmuskelerkrankung. Es werden spezifische guide-RNAs für eine CRISPR/Cas-basierte Gentherapie der DMD entwickelt und in Nanopartikel formuliert. Zunächst soll die Therapie in Organoidmodellen experimentell untersucht werden, ehe abschließend die Validierung im Großtiermodell erfolgt. Da das für DMD verantwortliche Dystrophin-Gen auf dem X-Chromosom liegt, verfolgt WP9 auch das Ziel, durch Manipulation epigenetischer Faktoren das intakte Dystroph in-Allel auf dem zweiten (inaktiven) X-Chromosom zu aktivieren.
Leiterin: Alessandra Moretti

PIs: Alessandra Moretti, Daniel Andergassen, Christian Kupatt
Partner:
Hepatitis B ist eine sehr häufige chronische Viruserkrankung, die schwer zu heilen ist. Die etablierte Therapie basiert auf der Verwendung von Nukleosid-Analoga, die die Virusvermehrung unterdrücken können, aber nicht heilbar sind. Interferon alpha kann Hepatitis B heilen, ist aber mit starken Nebenwirkungen verbunden, da es systemisch angewendet wird. Ziel dieses Teilprojekts ist es, Interferon-kodierende mRNAs in Nanopartikel zu verpacken und sie direkt in HBV-infizierte Lebern zu bringen.
Leitung: Arne Skerra

PIs: Arne Skerra, Ulrike Protzer, Carina de Oliveira Mann
Partner:


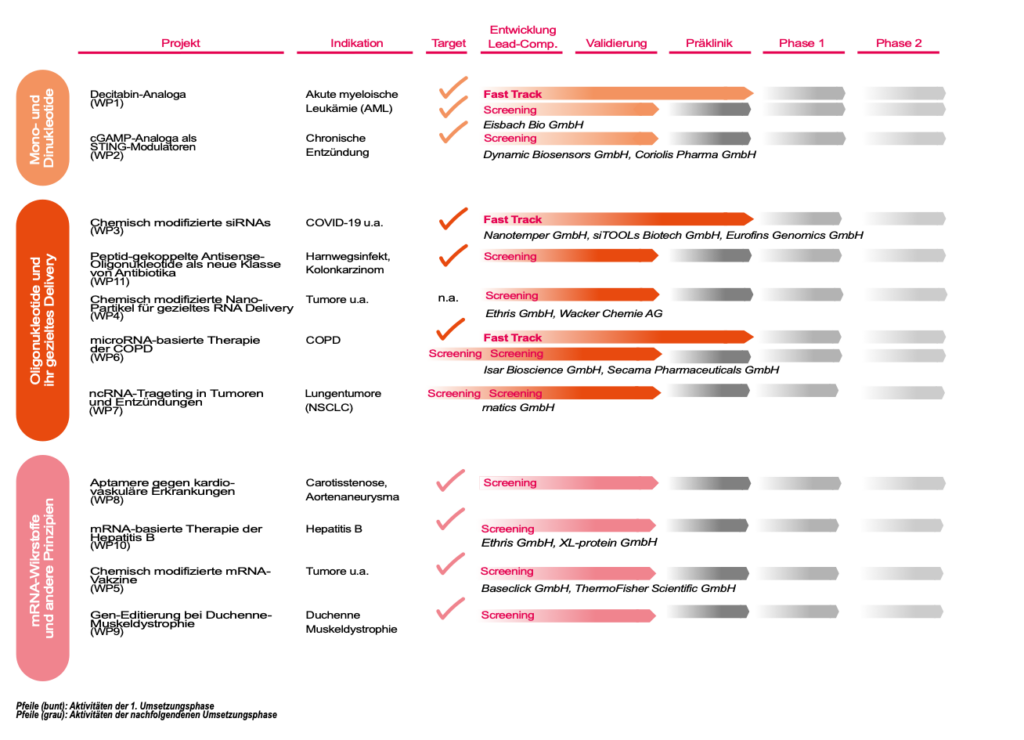
Projektübersicht und Pipeline der Wirkstoffentwicklung im CNATM Zukunftscluster:
Unternehmens-Kooperationen während der 1. Umsetzungsphase sind den Work packages zugeordnet.
VP: Verbundprojekt als organisatorische Zuordnung
